Resumen martes y jueves
El martes 23 vimos los métodos de separación de mezclas e hicimos un experimento para separar las sustancias del agua de mar utilizando 3 métodos:
Decantacion para separar el petroleo
Filtración para separar la arena
Evaporación para dejar solo la sal
El jueves realizamos un experimento sobre la purificación del agua y vimos modelos de las mezclas:
Físico
Matemático
Esquemático
Descriptivo.
lunes, 29 de agosto de 2011
sábado, 27 de agosto de 2011
Contaminación del Agua Semana 3 Jueves
Contaminación del agua, Purificación del agua, Modelos físicos de mezclas
| Preguntas | ¿Por qué el agua se contamina fácilmente? | ¿Cuales son los métodos de purificación del agua? | ¿En qué consisten los modelos físicos de mezclas? |
| Equipos: | 1-2 | 3-4 | 5-6 |
| Respuestas | Por que los seres humanos no sabemos cuidar el medio ambiente e invadimos espacios o reservas naturales, además de que el agua es el disolvente universal y es muy fácil de contaminarse. (: Por todos los contaminantes que se encuentran en el medio ambiente, por todas las acciones del hombre(desechos industriales,basura,animales muertos y todo lo que se encuentra en descomposición. JJJJ | ~SEDIMENTACION: Consiste en dejar el agua en reposo para que los materiales que posee se dirijan al fondo del envase. ~ FILTRACIÓN: Que es cuando filtramos el agua parcialmente clarificada a través de lechos de arena. ~ CLORACIÓN: Que es tratar el agua con agentes desinfectantes para eliminar los microorganismos que quedan. Equipo 3 Se denomina filtración al proceso de separación de sólidos en suspensión en un líquido mediante un medio poroso, que retine los sólidos y permite el pasaje del líquido, los cuáles pueden ser: Sedimentación Cloración Aireación …Y ya! :D xD | Un modelo físico es lo mismo que un modelo de la realidad, estos son utilizados para racionalizar, explicar y predecir fenómenos físicos a través de una teoría. Los modelos de teorías físicas son la realidad y una declaración de lo que se observa así como la predicción de nuevas observaciones. *Se suele desarrollar la definición sustituyendo los respectivos valores de ui en la expresión general del modelo de mezcla. |
Contaminación, purificación del agua y representación con modelos.
MATERIAL:
Vaso de precipitado 50 ml., agitador de vidrio, embudo de filtración y papel filtro, matraz erlenmeyer 150 ml, balanza, probeta graduada de 10 ml.
SUSTANCIAS:
Agua, suelo de cerro y carbón activado.
PROCEDIMIENTO:
- Colocar 30 ml. de agua en el vaso de precipitado,
- Adicionar: un gramo de suelo y agitar, observar y anotar el tipo de mezcla.
- Filtrar la mezcla y observar la solución filtrada.
- Colocar el carbón en el papel filtro y filtrar nuevamente, observar y anotar el tipo de mezcla.
OBSERVACIONES:
| EQUIPO | MEZCLA | MODELO ESCRITO | MODELO ESQUEMÁTICO | MODELO MATEMÁTICO | MODELO FÍSICO |
| | | | | |
Observaciones: Al agregar suelo a el agua se crea una mezcla homogénea. Despues de el filtrado el agua queda un poco turbia pero se elimina la mayor parte del suelo. Cuando se filtra con apoyo del carbon el agua vuelve a su claridad y transparencia caracteristica. A pesar de que en apariencia el agua es pura, se puede saber que aun esta contaminada por medio de el paso de corriente electrica, esta muestra de agua sirvio como conductor y encendio el foco lo que indica que no era agua pura.
CONCLUSIONES:
Modelo Científico
En ciencias puras y, sobre todo, en ciencias aplicadas, se denomina modelo científico a una representación abstracta, conceptual, gráfica o visual (por ejemplo: mapa conceptual), física, matemática, de fenómenos, sistemas o procesos a fin de analizar, describir, explicar, simular - en general, explorar, controlar y predecir- esos fenómenos o procesos.
Un modelo permite determinar un resultado final o output a partir de unos datos de entrada o inputs.
Se considera que la creación de un modelo es una parte esencial de toda actividad científica.
§ Modelo escrito o verbal de mezcla: Es la unión física de un compuesto y elementos.
§ Modelo gráfico o esquemático: todo (agua y tierra)
§ Modelo simbólico o matemático o númerico: simbolos, H,O, Fe, Na, fórmulas H2O, FeO, NaCl, NaCl, Na2CO3.
§ Modelo físico: se utilizan materiales para su representación; por ejemplo: esferas de unicel, plastilina, etc.
§ Modelos computacionales, en los que con programas de ordenador se imita el funcionamiento de sistemas complejos.
Métodos de Separación de Mezclas Semana 3 Martes
MÉTODOS DE SEPARACIÓN Y ACTIVIDAD DE LABORATORIO.
Métodos de separación.
| Equipos | 2 | 1 | 4 | 5 | 3 | 6 |
| Método de separación | Decantación | Filtración | Evaporación | Cromatografía | Destilación | Cristalización |
| Definición | Es el procedimiento de decantación, conciste en separar componentes que contiene diferentes fases,(ejemplo: 2 liquidosno pueden mezclarse;)Mezclas heterogéneas y consiste en sedimentación del material solido JJ. | Es un tipo de separación mecánica que sirve para separar sólidos insolubles de grano fino de un liquido en el cual se encuentran mezclados. Se utiliza papel filtro o lechos de arena para que se queden atrapadas los contaminantes químicos. | Trata del cambio de estado de liquido a gaseoso en la cual una sustancia se puede separar de otra por su punto de ebullición. | Para llevarla a cabo se requiere un material poroso, denominado soporte que sea capaz de absorber la mezcla que deseamos separar. Una vez que esta mezcla se integra al soporte, la empezamos a impulsar para que corra a través del cuerpo poroso agregando continuamente un fluido que llamamos eluyente. Después de un tiempo los componentes se van separando. | Es la operación de separar mediante evaporización y condensación los diferentes componentes líquidos y sólidos disueltos en líquidos o gases mezclados aprovechando los diferentes puntos de ebullición. | Para efectuar la cristalización de un sólido hay que partir de una solución sobresaturada existen varias formas de sobresaturar una solución una de ellas es el enfriamiento de una solución, otro de ellos consiste en eliminar parte del disolvente a fin de aumentar la concentración de soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el que el componente que se desea cristalizar. |
Actividad de laboratorio 3
Métodos de separación de mezclas.
En la Tierra la mezcla liquida que más existe:
*El agua de mar agua, sal, arena, petróleo
¿Cuáles son los métodos de separación del agua de mar?
Decantacion Separacion del petróleo.
*Filtración, elimina la arena.
*Filtrado agua salada, evaporación, el agua se evapora y pierde, destilación, se obtiene agua pura.
Material:
Vaso de precipitados 50 ml, papel filtro, embudo de filtración, lámpara de alcohol, capsula de porcelana, soporte universal o tripie.
Sustancias: Agua, cloruro de sodio, arena, petróleo.
Procedimiento:
a) Formar una mezcla de agua salada, medir 25 ml de agua y adicionar media 3 gramos de cloruro de sodio.
b) Adicionar a la mezcla anterior un gramo de arena.
c) Adicionar a la mezcla anterior dos mililitros de petróleo.
d) Agitar y determinar el tipo de mezcla obtenido.
e) Separar el petróleo
f) Filtrar la mezcla.
g) Evaporar el filtrado. Escribir los cambios observados en cada paso:
Agua con Cloruro de Sodio

mezcla con arena

Despues de agregar el petroleo

Decantacion

Filtracion

evaporacio
| Observaciones:) | |
| A | |
| B | |
| C | |
| D | |
| E | |
| F G | Después |
Conclusiones:
Aquí se toma como ejemplo el liquido mas abundante del planeta, el agua de mar que se conforma por cuatro sustancias principales:agua, sal, petroleo y arena. Estos componentes utilizan 3 métodos diferentes para su apreciación individual: decantacion, filtración y evaporación.
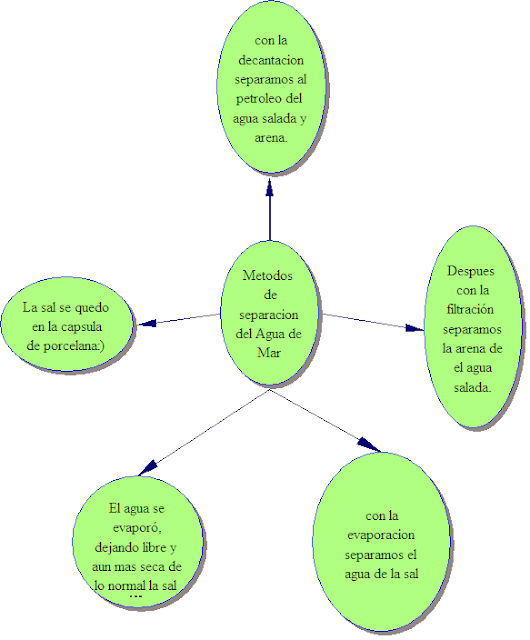
Metodos de separacion del Agua de Mar
I. con la decantacion separamos al petroleo del agua salada y arena.
II. Despues con la filtración separamos la arena de el agua salada.
III. con la evaporacion separamos el agua de la sal
IV. El agua se evaporó, dejando libre y aun mas seca de lo normal la sal :D
V. La sal se quedo
en la capsula de porcelana:)
Purificación del agua
Modelos físicos de mezclas
Métodos de separación
Contaminación del agua se produce debido a que es un poderoso disolvente.
Purificación del agua
Por filtro de piedra, la evaporación, por rayos ultravioleta, decantación, cristalización, ozono.
Modelos físicos de mezclas
Los modelos pueden ser:
*Escrito. Es la unión de dos o más compuestos y elementos
*Esquemático. (Pueden ser iguales o diferentes los componentes).
*Simbólico, formulas, matemático: agua=H2O, cloruro de sodio= NaCl, mármol= Na2CO3, sacarosa= C12H22O11
*Físico: Materiales. Plastilina, gomitas, unicel, cartón, mercurio, etc.…
*Videos: documentales de mezclas.
*Simuladores: las computadoras, la web
sábado, 20 de agosto de 2011
Recapitulación Semana 2
Recapitulacion 2
Resumen del martes y jueves
Lectura del resumen
Aclaracion de dudas
Ejercicio
Registro de asistencia
| Equipo | Resumen |
| 1 | Martes: De acuerdo a la información que traía cada equipo contestamos unas preguntas acerca de capacidad de disolución del agua y otros disolventes. Realizamos una practica para comprobar las respuestas Jueves: Llenamos un cuadro con la información que ya teníamos acerca de tipos de mezclas: · Homogéneas · Heterogéneas Al finalizar realizamos una practica la cual nos daría la respuesta verídica. |
| 2 | Martes: El día martes determinamos porque el agua es disolvente universal, determinamos sobre todo lo que tenga que ver con el agua h2o,verificamos sobre otros disolventes que eran solubles en agua, y sobre todo determinamos que el agua es la principal fuente de vida. Jueves: él día jueves nos nos especificamos en la importancia de el agua,ya que el agua es el disolvente universal, también después de el tema relacionado pasamos a realizar una práctica de disolventes, y determinamos y especificamos que es una mezcla homogénea y heterogénea. JJJJJJJJJJ |
| 3 | Martes 15 Aprendimos sobre la importancia del agua, la cual es un disolvente, y los diferentes tipos de mezcla (Homogéneas y Heterogéneas). Jueves 17 Llenamos un cuadro de mezclas e hicimos experimentos con distintos solutos (Suelo del Cerro de Zacatepetl, Cloruro de Sodio, Sacarosa) y disolventes (Petróleo, Alcohol, Agua) |
| 4 | Esta semana aprendimos sobre la importancia del agua, que es el disolvente Universal. Discutimos sobre los conceptos de “soluto” y “disolvente” y llegamos a la conclusión que: un disolvente es la sustancia que esta en mayor cantidad en una mezcla. Y que un soluto es la sustancia que se encontraba en menor cantidad. Tambien hablamos sobre los dos tipos de mezclas que son, la homogénea y la heterogenea. Al finalizar hicimos 2 experimentos para decifrar que mezclas eran homogéneas o heterogeneas, y el otro sobre cual disolvente era mejor entre el alcohol, petróleo, o agua. |
| 5 | Martes: por equipo contestamos una pregunta y la plasmamos en el pizarrón. Después de contestar esa pregunta hicimos una práctica de disolventes en el cual utilizamos agua, alcohol etílico y petróleo. Los solutos fueron: sacarosa, mármol y cloruro de sodio. Jueves: hicimos una práctica relacionada con los tipos de mezclas (homogénea y heterogénea); como disolventes se ocuparon: agua, Alcohol etílico y petróleo. Como solutos utilizamos: cloruro de sodio, sacarosa, arena de mar y suelo. |
| 6 | Esta semana la comenzamos, contestando unas preguntas, ese mismo dia hicimos nuestra primera practica y trato de ver cual de los solventes disolvía mejor. En nuestra 2° clase de la semana también hicimos una practica y trato de ver las mezclas y tipos de mezclas. |
Mezclas Semana 2 Experimento 2
Q1Semana 2Jueves
Definición de mezclas
| Equipos | ¿Qué es una mezcla? | ¿Cuántos tipos de mezclas existen? |
| 1-6 | Es una materia formada por diferentes moléculas en cambio las materias formadas por moléculas que son todas iguales reciben el nombre de compuesto químico o sustancia químicamente pura. En una mezcla no se producen cambios químicos sin embargo las propiedades químicas pueden diferir. | Existen 2 tipos de mezclas, Homogénea y heterogénea: La Homogénea es aquella en la que no se notan sus componentes a simple vista y la heterogenia es en la cual sus componentes se ven fácilmente. |
| 2-5 | En química una mezcla, es un material formado por 2 o más sustancias puras, pero no combinadas químicamente. En una mezcla no ocurre una reacción química y cada uno de sus componentes mantiene su identidad y propiedades químicas. >.< | -Mezcla homogénea: Se producen cuando se unen sustancias puras en proporción variable sin que ninguna pierda sus propiedades originales. Sus componentes no se perciben a simple vista, ni siquiera con ayuda de microscopio. Está formada por un soluto y un solvente. -Mezcla heterogénea: Es aquella que posee una composición no uniforme en la cual se pueden distinguir a simple vista sus componentes y está formada por dos o más sustancias, físicamente distintas, distribuidas en forma desigual. |
| 3-4 | En Química una mezcla es un sistema material formado por 2 o más sustancias puras no combinadas químicamente. En una mezcla no ocurre una reacción química y cada uno de sus componentes mantiene su identidad y propiedades químicas. MEZCLAS HETEROGÉNEAS No son uniformes; en algunos casos puede observarse la discontinuidad a simple vista (sal y carbón, por ejemplo); en otros casos debe usarse una mayor resolución para observar la discontinuidad. MEZCLA HOMOGÉNEA Son totalmente uniformes (no presentan discontinuidades al ultramicroscopio) y se presentan iguales propiedades y composición en todo el sistema, algunos ejemplos son la Salmuera, el aire. Estas mezclas homogéneas se denominan soluciones. | Existen dos grandes tipos de mezclas: las homogéneas y las heterogéneas. Las homogéneas son cuando se unen sustancias puras en proporción variable, sin que ninguna pierda sus propiedades originales. Sus componentes no pueden verse a simple vista ya que forman una sola fase. Dentro de estas se encuentran las disoluciones. Las heterogéneas constituyen una composición no uniforme. Dentro de ellas se encuentran las suspensiones y coloides |
Química: es la ciencia que estudia la materia, y todas sus transformaciones debidas a la energía aplicada.
La materia se presenta en la Naturaleza en los estados de agregación:
| Estado de agregación: | solido | liquido | gaseoso |
| Solido | solido-solido Azúcar y arena | solido-liquido Suelo-húmedo | Solido- gaseoso. Piedra pómez, tezontle |
| Liquido | Liquido solido Agua y granos de café | Liquido-liquido Agua y jugo de limón | líquido- gaseoso Un refresco, por ejemplo la Coca-Cola |
| Gaseoso | Gaseoso-solido Globo inflado | Gaseoso-liquido Aire húmedo (humedad) | gaseoso- gaseoso tanque de gas(combinación) J |
EXPERIMENTO 2.
Mezclas y tipo de mezclas.
-Determinar el tipo de mezclas se obtienen al unir las sustancias: liquidas y solidas.
Mezclas y tipo de mezclas.
-Determinar el tipo de mezclas se obtienen al unir las sustancias: liquidas y solidas.

Material: Vaso de precipitados de 100 ml., agitador de vidrio, balanza granataria, probeta graduada de 50 ml.
Sustancias: Agua, alcohol etanol, petróleo, cloruro de sodio, mármol, suelo, sacarosa.
Procedimiento:
Ø Medir 10 ml de la sustancia liquida y colocarla en el vaso de precipitados.
Ø Pesar un gramo de la sustancia solida y adicionarla a líquido, agitar y observar, anotar el tipo mezcla obtenida.
Observaciones:
| Sustancia | Cloruro de sodio | Sacarosa | Arena de mar | Suelo |
| Agua | Homogéneo | | | Homogéneo |
| Alcohol etanol | | Heterogéneo | Heterogéneo | Heterogéneo |
| Petróleo | Heterogéneo | | | Heterogéneo |
CONCLUSIONES:
Es fácil diferenciar ambos tipos de mezclas, en las homogéneas no es posible observar las sustancias que dieron origen a la mezcla y en las heterogéneas pueden distinguirse algunos fragmentos o la totalidad de las sustancias que originaron la mezcla.
Para la formación de mezclas homogéneas el agua es la mejor opción como solvente, a diferencia del alcohol y el petroleo que no consiguieron formar una mezcla homogénea con ninguna sustancia.
Suscribirse a:
Entradas (Atom)